Fonaments de l’espectrometria de masses
L’espectrometria de masses és una tècnica d’anàlisi emprada per a obtenir informació tant quantitativa com qualitativa de la composició atòmica i molecular de materials orgànics i inorgànics.
Entre els principals atributs de l’espectrometria de masses es troben la seva gran sensibilitat, ja que només requereix uns quants mil·ligrams, o fins i tot nanograms, de mostra per a dur a terme l’anàlisi, i la seva alta especificitat per a identificar substàncies desconegudes o confirmar la presència de determinats compostos en alguna mostra.
El principi de l’espectrometria de masses és la producció d’ions a partir d’un compost neutre i l’anàlisi posterior d’aquests ions. Quan a una molècula se li subministra una determinada energia es descompon seguint un patró concret, obtenint-se sempre els mateixos fragments (ions) i en la mateixa relació d’intensitat (quantitat relativa dels fragments), característics de cada molècula. Aquest patró concret es representa gràficament en el que es denomina l’espectre de masses, que permet la identificació de la substància.
Les molècules es ionitzen perden primer l’electró amb un potencial d’ionització més baix i formen el que es denomina ió molecular (o ió pare, representat com M+), que després es trenca en fragments (que molts d’ells també posseeixen càrrega) que s’acceleren a gran velocitat i que són detectats en funció de la seva relació m/z (massa/ càrrega del ió). És a dir, només es detecten els bocins procedents del ió molecular que presenten càrrega elèctrica positiva, així els radicals no sortiran a l’espectre i els ions negatius tampoc.
L’aparell que fa això es diu espectròmetre de masses, i no sols classifica els fragments indicant la seva massa, sinó que a més mesura la quantitat relativa de cadascú d’ells que es forma. Aquest espectre és característic per a cada compost, i és capaç de distingir entre isòmers. Per exemple:
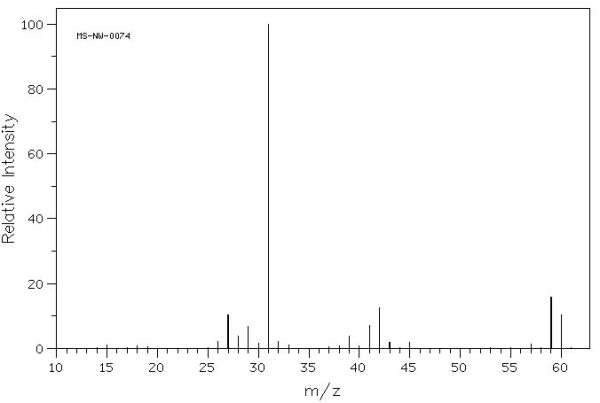
Aquest és l’espectre de masses del 1-propanol. El ió molecular (CH3-CH2-CH2OH+) apareix com el pic amb un valor de massa més gran (60), que correspon a la massa de la molècula del compost. No és el pic més alt ja que no és el fragment més estable.
Al fragment més estable s’assigna sempre una intensitat relativa del 100% ja que és el més abundant en la mescla de ions que es produeix. En aquest cas correspon al fragment CH2OH+ amb una relació càrrega/massa=31.
Aquest altre espectre és el del 2-propanol (isòmer del 1-propanol) i és bastant diferent. Per una banda, no es veu el pic corresponent M+, ja que el ió molecular és molt inestable i es descomposa totalment abans de poder ser registrat.
Per altra banda, ara el fragment més estable correspon a CH3-CHOH+, ja que la fractura més probable en els alcohols és entre el carboni del OH i el contigu.
L’espectrometria de masses també serveix per identificar isòtops dels elements. Si s’analitza un element determinat l’espectre ens indicarà la massa dels isòtops de la mostra i la seva abundància relativa. Per exemple:
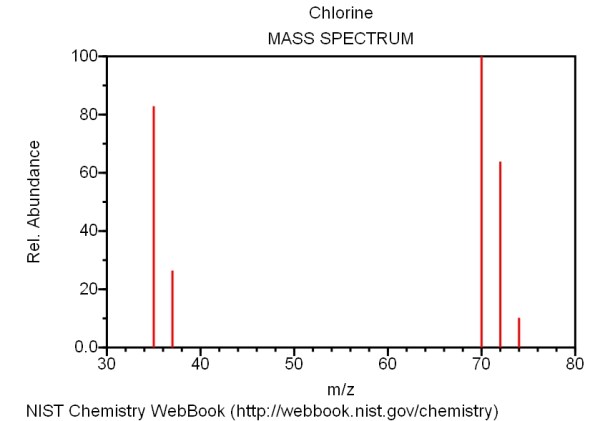
Aquest espectre s’ha obtingut de la pàgina del NIST, ja que a la base de dades de l’AIST no hi és, però hi ha altres eines específiques per obtenir espectres de masses del elements com per exemple les de l’empresa americana Scientific Instrument Service, que proporcionen instantàniament l’espectre només ficant el símbol de l’element.
Formació del ió molecular i la seva fragmentació
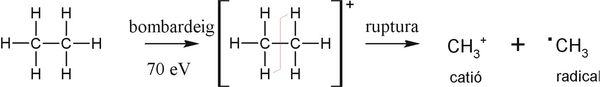
La ionització d’una molècula orgànica normalment requereix d’aproximadament de 10-15 eV, amb la qual cosa és factible obtenir el ió molecular. No obstant, en l’espectrometria de masses, les molècules se sotmeten a un bombardeig electrònic de 70 eV. D’aquesta manera un electró és remogut de la molècula formant un catió d’alta energia i a continuació eventualment el catió es fragmenta per a dissipar el seu excés d’energia.
Alguns compostos estabilitzen la càrrega per mitjà de la seva deslocalització aconseguint així que el ió molecular duri prou per a ser detectat. Altres ions moleculars tenen una durada relativament curta, de tal forma que algunes vegades no poden ser observats i en aquestes circumstàncies es detecta únicament els senyals de les espècies provinents de la fragmentació de l’ió molecular. Com a regla general l’electró es perdrà del lloc a la molècula que pugui ionitzar-se més fàcilment.
Així, els electrons d’àtoms com O, N, S, halògens, o d’una insaturació (dobles o triples enllaços) són més fàcils d’arrancar de la molècula i, per altra banda, els enllaços C – C es poden ionitzar amb major facilitat que els enllaços C – H.
Si no es te prou coneixements de química orgànica és difícil preveure com es trencaran els ions moleculars, però es poden donar algunes normes que poden ajudar a resoldre problemes senzills:
- Els alcans de cadena lineal es trenquen amb més facilitat per l’enllaç C – C més proper a la meitat de la molècula, i després es tenen pèrdues successives d’unitats amb massa 14 (CH2).
- En els hidrocarburs ramificats, la fragmentació tendeix a presentar-se al lloc de la ramificació.
- En els hidrocarburs insaturats és més fàcil que la ruptura es produeixi en l’enllaç C – C que no sigui contigu al doble o triple enllaç.
- En els alcohols, amines i èters el procés de fragmentació més comú és la ruptura de l’enllaç entre el carboni de la funció i el següent.
- En els halurs d’alquil (derivats halogenats) el procés de fragmentació més comú a partir del ió molecular és la ruptura de l’enllaç C – X.
- En els èsters, aldehids i cetones, es trenca l’enllaç entre el carboni del grup carbonil i un àtom adjunt.
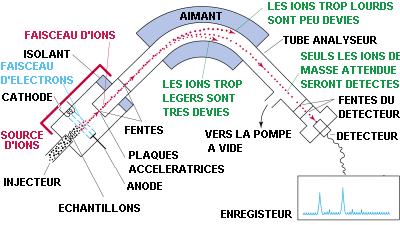
Espectròmetre de masses
El primer espectròmetre de masses va ser construït a Anglaterra per J. J. Thompson en 1912, encara que el primer similar als actuals no es va fer fins 1932. Com hem dit, l’espectròmetre de masses converteix les molècules del compost a estudiar en una mescla de fragments carregats composta per un ió molecular (ió pare) i altres fragments iònics. Aquestes partícules són ordenades d’acord amb la seva relació massa/càrrega i les seves abundàncies són mesurades amb relació a l’abundància del fragment més estable (pic base) que es pren del 100%. Al graficar les dades de massa/càrrega respecte a l’abundància relativa de tots els fragments procedents de les molècules del compost estudiat, s’obté el seu Espectre de Masses.
Els espectròmetres de masses són instruments que en general consten de:
- Un sistema d’introducció de mostra, que pot ser entre altres un cromatògraf de líquids o un cromatògraf de gasos.
- Una font de ionització, que és on es produeix la fragmentació molecular característica de cada compost, per aplicació d’una determinada energia.
- Un analitzador que separa els fragments iònics generats en funció de la seva relació massa/càrrega. Aquesta separació es produeix per aplicació de diferents camps elèctrics i magnètics.
- Un detector que recull i caracteritza els fragments iònics que surten de l’analitzador.
A més tot el sistema es troba sotmès a alt buit (l0-2 a l0-3 Pa.) per a evitar col·lisions entre els fragments iònics generats.
Funcionament d’un espectròmetre de masses:
Les mostres es volatilitzen escalfant al buit i després el vapor es deixa passar a la cambra de ionització. Moltes vegades acoblat a l’espectròmetre, com a la foto de dalt, i com a pas previ, hi ha un cromatògraf que separa els components de la mostra a analitzar.
A la cambra de ionització, la mostra se sotmet al bombardeig d’electrons amb una energia d’uns 70 eV. L’energia absorbida per les molècules produeix la ionització per pèrdua d’electrons dels orbitals moleculars. Els ions formats per l’extracció d’un electró de la molècula original es denominen ions moleculars o ions pares. Alguns dels ions moleculars es fragmenten en ions més petits i en fragments neutres. Es formaran tant ions positius com negatius, però només les espècies carregades positivament són les que interessen. Es fa ús d’un petit potencial positiu per a repel·lir els ions positius fora de la cambra de ionització.
A continuació, s’aplica un potencial positiu de 2000 V a una sèrie de plaques enfront de la cambra de ionització amb la finalitat d’accelerar els ions positius a través d’una sèrie d’escletxes cap a una zona en la que son sotmesos a un camp magnètic. La velocitat a la que surten els ions sol ser d’uns 100 Km/s.
En passar els ions entre les plaques de l’electroimant es desvien per efecte del camp magnètic, depenent de la seva relació massa/càrrega. Per exemple, el ió C3H8+ es desvia en menor grau que el ió C2H6+, pel fet que té la massa més gran. Així el feix de ions inicial es divideix en feixos de ions cadascú amb una relació de massa/càrrega diferent.
Com a curiositat, normalment el radi de gir (R) és d’uns 35-50 cm i el tub analitzador és un sector esfèric d’aproximadament un metre de longitud.
Per últim, cada feix de ions es fa passar a través d’una escletxa a la zona del col·lector, i incideix sobre la placa del col·lector. Cada ió adquireix un electró de la placa amb el qual es neutralitza la càrrega positiva i produeix un corrent al circuit del col·lector, el qual s’amplifica i es registra en funció de la relació massa/càrrega. La grandària de cada pic correspon a la mesura del número relatiu de ions en cada feix.
Una mica de la física del moviment de les partícules carregades
Al dibuix de sota tenim un esquema simple d’un espectròmetre de masses que pretén explicar com es separen els ions positius. Mitjançant el cap elèctric E són accelerats a la velocitat desitjada, ja que el camp elèctric actua amb una força que ve donada per l’expressió: Fe = q·E, que subministra una energia cinètica als ions W = q·U = m·v2/2, on U és el voltatge aplicat entre les plaques i v és la velocitat de sortida per l’escletxa dels ions amb massa m.
Moltes vegades en aquest tram es combina el cap elèctric amb un camp magnètic. Com veurem a continuació, el camp magnètic desvia els ions en funció de la seva massa i velocitat, de manera que combinat els dos camps és possible aconseguir que per l’escletxa passin només les partícules que tinguin una determinada velocitat, aquella que ve donada per la relació v = E/B.
Quan els ions entren entre les plaques de l’electroimant el camp magnètic aplicat, B, els desvia com a conseqüència de la força que exerceix sobre les partícules carregades, Fm = q·v·B, seguint trajectòries semicirculars.
Ara, aplicant l’equació de la dinàmica del moviment circular uniforme, F = m·v2/r, es troba el radi, r, de la trajectòria circular.
Si, F = m·v2/r = q·v·B = Fm i aïllem r
r = m·v/q·B
És a dir, per una velocitat dels ions i un camp magnètic determinat, i tenint en compte que els ions tenen una càrrega unitat positiva, el radi de curvatura depèn únicament de la massa.
Contribucions isotòpiques
Ja s’ha indicat que l’espectrometria de masses pot servir per identificar els diferents isòtops dels que està composat un element de manera natural (o artificial). De la mateixa manera que els elements tenen una mescla d’isòtops determinada, els seus compostos també la mantenen i, per tant, els compostos orgànics també es troben en forma de mescles isotòpiques.
La presència d’isòtops, en especial els de C, Cl, Br i S poden originar més d’un ió molecular, amb altures proporcionals a les seves abundàncies naturals.
| C12 – 98.89% C13 – 1.11% | Cl35 – 75.53% Cl37 – 24.47% | Br79 – 50.52% Br81 – 50.52% | S32 – 95.02% S34 – 4.22% |
| Abundàncies naturals dels isòtops del C, Cl, Br i S (no es contemplen els isòtops amb abundàncies per sota de l’1 %) | |||
L’abundància isotòpica, no només afecta el ió molecular, sinó a tots el fragments generats que continguin l’isòtop en qüestió. Per exemple, si un compost conté brom; el ió molecular tindrà els isòtops Br79 i Br81 casi en la mateixa proporció (abundància 50.52% i 49.48%, respectivament). Les contribucions isotòpiques es manifestaran en la presència de dos senyals per al ió molecular (i fragments que continguin brom) d’intensitat relativa d’1:1, aproximadament. D’aquesta mateixa manera, en el cas de tenir clor en compte de brom el mateix compost tindria també dos senyals a causa del Cl35 (75,53%) i del Cl37 (24.47%) separades per dos unitats, però les intensitats en aquest cas seran de 3: 1.

Exemple d’un problema resolt
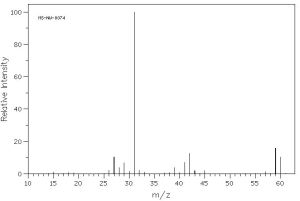
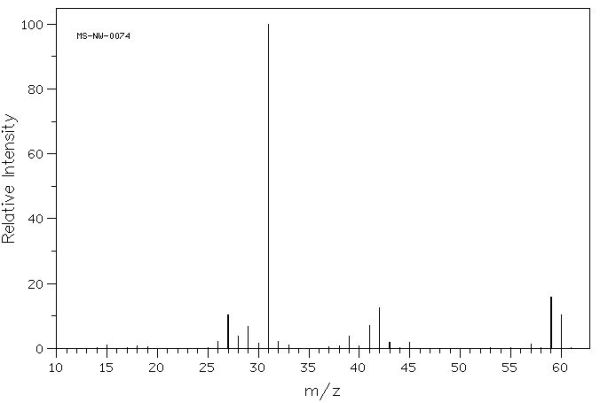
L’anàlisi elemental d’un compost orgànic ha donat com a resultat un 13,3 % d’hidrogen, un 60,0 % de carboni i un 26,7 % d’oxigen, pel que es pot afirmar que es tracta de la substància que te per fórmula empírica C3H8O. En fer l’espectre de masses del compost s’obté el següent:
A quin compost ens estem referint?
Solució
Si el compost te per fórmula empírica C3H8O, tindrà una massa:
M (C3H8O) = 3×12 + 8×1 + 1×16 = 60
o múltiple. Com 60 coincideix amb la massa de el ió molecular, M+, que dóna l’espectre, es pot afirmar que la fórmula molecular és també: C3H8O. Amb aquesta fórmula existeixen diferents isòmers: 1-propanol, 2-propanol i l’etil-metil èter.
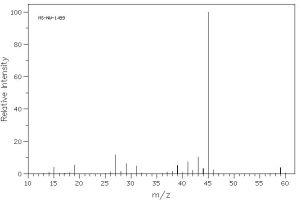
En l’espectre de masses trobem el pic més abundant amb una massa 31, corresponent a CH2OH+, que no trobaríem al 2-propanol i que no seria el més abundant a l’etil-metil èter, ja que els trencaments principals serien:
1-propanol: CH3 – CH2 – CH2OH → C2H5 + CH2OH+ (=31)
2-propanol: CH3 – CHOH – CH3 → CH3 + CH3 – CHOH+ (=45)
etil-metil èter: CH3 – CH2 –O – CH3 → CH3 + CH3 – CH2O+ (=45)
Pel que es pot concloure que la substància problema és l’1-propanol.
Enllaços per ampliar informació

La Royal Society of Chemistry va publicar fa temps un llibre titulat Modern Chemical Techniques : An Essential Reference for Students and Teachers amb propostes per estudiar tècniques d’anàlisi espectroscòpic al que seria el nostre batxillerat (16 – 18 anys). Actualment (2015) amb el nom de Modern Chemical Techniques: background reading for chemistry teachers ha ficat a l’abast de tothom en format PDF i per capítols el contingut actualitzat d’aquell llibre. En concret pel que aquí interessa la unitat Modern chemical techniques: mass spectrometry.
A la web de Libretexts. Español es troben gran quantitat de llibres en espanyol de diferents disciplines i de lliure accés amb llicència de creative commons. Entre ells, a l’apartat de Química General, està Estructura y Reactividad en Química Orgánica, Biológica e Inorgánica II: Aspectos Prácticos de la Estructura – Purificación y Espectroscopia, que conté un capítol dedicat a l’Espectroscòpia de masses, amb exercicis resolts intercalats entre la teoria. El llibre ha estat escrit pel professor Chris Schaller del College of Saint Benedict a la Saint John’s University
Han eliminat els continguts de l’estupenda web Quiored, escrita entre els anys 2002 i 2004 per un grup de professors i alumnes del Departamento de Química Orgánica de la facultat de ciències de la Universidad de Granada, però un dels seus creadors, el professor Jose A. Dobado, ha replicat una part d’ella a la web De Química on hi ha un apartat específic d’espectrometria de masses dins la pestanya Laboratorio (Determinación estructural de Compuestos Orgánicos mediante Métodos Espectroscópicos).
Exemples d’espectres de diferents tipus i de diferents compostos es poden aconseguir en les bases de dades de diferents entitats com el National Institute of Standars and Technology (NIST) del departament de comerç dels Estats Units o el National Institute of Advanced Industrial Science and Technology (AIST) de Japó.
Eines específiques per obtenir espectres de masses es troben a la web de l’empresa americana Scientific Instrument Service, que proporcionen instantàniament l’espectre, només ficant el símbol de l’element o la fórmula del compost.




Sóc una estudiant de Segon de Batxillerat a qui li agrada molt la pàgina i trobo que és molt interessant i a la vegada difícil d’entendre determinats conceptes.
No acabo d’entendre per quin motiu es pot afirmar que aquesta substància té aquesta fórmula empírica. Em pregunto si em podríeu explicar el perquè.
L’anàlisi elemental d’un compost orgànic ha donat com a resultat un 13,3 % d’hidrogen, un 60,0 % de carboni i un 26,7 % d’oxigen, pel que es pot afirmar que es tracta de la substància que te per fórmula empírica C3H8O.
D’altra banda, aquest juny em presento a les PAU i m’agradaria saber si em poden fer comentar una gràfic de la mamera com s’explica aquí o si seria d’una manera més general.
Moltes gràcies!
Hola Anna,
Tens raó que no explico com, a partir dels percentatges dels diferents elements que surten en un anàlisi elemental, s’obté la fórmula empírica d’un compost. No l’he ficat per no induir a engany i fer pensar que és un contingut de segon de batxillerat.
L’obtenció de fórmules de compostos a partir dels percentatges en massa dels elements que els composen s’estudia a primer de batxillerat i, en principi, però mai és segur, no hauria d’aparèixer en els exàmens de selectivitat.
En tot cas, a continuació l’explico:
L’anàlisi elemental d’un compost orgànic ha donat com a resultat un 13,3 % d’hidrogen, un 60,0 % de carboni i un 26,7 % d’oxigen, pel que es pot afirmar que es tracta de la substància que te per fórmula empírica C3H8O. Per què?
———————————————————————–
Calcularem la fórmula empírica del compost i després la molecular
Primer es divideix cada tant per cent per la massa atòmica de cada element, per trobar la proporció d’àtoms de cada element en la molècula
H = 13,3/1 = 13,3
C = 60,0/12 = 5
O = 26,7/16 = 1,7
Dividim ara cada quantitat pel número més petit, per trobar proporcions senceres.
H = 13,3/1,7 = 8
C = 5/1,7 = 3
O = 1,771,7 = 1
Per tant podem concloure que la fórmula empírica del compost és C3H8O, amb una massa: M (C3H8O) = 3×12 + 8×1 + 1×16 = 60, que coincideix amb la massa de l’ió molecular, M+, que ens dona l’espectre. Per tant la fórmula molecular és també : C3H8O.
———————————————————–
Respecte a la segona pregunta que fas, si et poden ficar un problema d’aquest tipus, te recomano que miris els exemples de problemes resolts dels nous continguts a avaluar a les Paau aquest juny vinent:
Enunciats:
Feu clic per accedir a pau_quim6.pdf
Solucions:
Feu clic per accedir a pau_quim7.pdf
En concret, respecte a l’espectrometria de masses, fiquen aquest exemple:
——————————————————————–
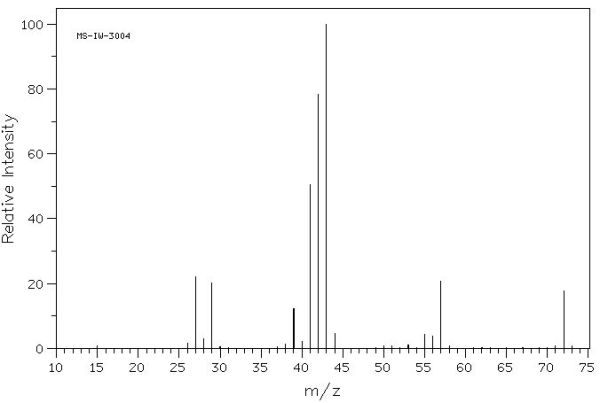
Quan s’analitza la butanona, CH3CH2COCH3, per espectrometria de masses, s’obtenen els següents valors del quocient massa/càrrega: 72, 57, 43, 42, 29, 27 i 15.
a) Indiqueu, breument, els processos bàsics que tenen lloc quan un compost és analitzat per espectrometria de masses.
b) Indiqueu a quin ió poden correspondre els pics amb els valors de massa/càrrega 72 i 43, suposant que la càrrega es la unitat. Aquests dos pics es veurien si en lloc de la butanona s’hagués analitzat la propanona? Raoneu les respostes.
Dades. Masses atòmiques relatives: C = 12; O= 16; H=1
———————————————————————-
Espero que aquesta resposta et sigui d’ajuda. Aprofito per animar-te a estudiar fins l’últim dia abans de l’examen ja que quant més preparada te trobis, més tranquila estaràs el dia del examen i millor el faràs.
[…] espectrometria de masses […]
Hola Sr. Lorenzo,
Em dic Daniel i em presento a la Selectivitat d’aquest curs 2011-2012. M’agradaria saber fins a quin punt consideres necessari l’aprenenatge del funcionament o procés d’anàlisi de l’espectròmetre de masses, l’aparell d’RMN, etc. Creus que és important, o és potser quelcom interessant però que probablement no entrarà en l’examen?
Ja de passada, m’agradaria felicitar-te pel web. És molt bo i dóna molt bones explicacions a tot.
Moltes gràcies!
Hola Daniel,
Moltes gràcies per la teva felicitació. Me’n alegro que la web te sigui d’utilitat.
Quant a la pregunta que fas respecte a la selectivitat, el que cau i el que cal estudiar te comento el que segueix:
• El professorat que prepara els exàmens de selectivitat a Catalunya ho fa tenint en compte el currículum oficial de l’assignatura de segon de batxillerat (http://phobos.xtec.cat/edubib/intranet/file.php?file=docs/Batxillerat/Curriculum%20mat%E8ries/Modalitat%20de%20ci%E8ncies%20i%20tecnologia/quimica.pdf), on figura com a contingut a estudiar el següent: “Descripció d’alguns dels mètodes actuals emprats per l’anàlisi de substàncies: espectroscòpia IR i ressonància magnètica nuclear. Fonament de l’espectroscòpia de masses”
Per tant, poden preguntar en algú dels apartats sobre els fonaments de les tècniques o com s’utilitzen.
• El curs passat va ser el primer en el que van sortir continguts d’anàlisi espectroscòpic en els exàmens de selectivitat. Per exemple, al juny passat (http://www.gencat.cat/economia/ur/doc_un/pau_quim11jl.pdf), van ficar la pregunta 7 (sèrie 1) següent
a) Indiqueu quina magnitud es representa en cadascun dels eixos d’un espectre infraroig. Expliqueu breument el procés que experimenta un compost químic quan és irradiat amb radiació infraroja. [1 punt]
b) Considereu les substàncies químiques següents:
He CH4 CH3CH2CH2CH2CH2CH2CH2OH NH2CH2COOH
Indiqueu quin o quins compostos no produeix cap pic en un espectre infraroig i quin en produeix més. Justifiqueu les respostes. [1 punt]
Com pots veure, has d’haver estudiat els fonaments de l’espectroscòpia IR per a poder contestar adequadament.
• En la web de les Paau han penjat un document amb models d’exercicis (http://www.gencat.cat/economia/ur/doc_un/pau_quim6.pdf) de nous continguts avaluables en les PAU 2012 de química amb les seves solucions.
Si el mires, veuràs que sobre tot pregunten per fonaments de les tècniques o per interpretació d’espectres, però no pel funcionament dels aparells amb els que es realitzen els anàlisis corresponents.
En conclusió, el meu consell respecte a la selectivitat és que estudiïs tot en conjunt per fer-te una idea general dels mètodes espectroscòpics i que després et centris en els fonaments de cada tècnica i en els exercicis d’interpretació d’espectres.
Però tinc un altre consell: Abans de presentar-te a la selectivitat has d’aprovar la matèria de Química de segon de batxillerat, per tant has d’estudiar el que et digui el teu professor o professora de l’assignatura i seguir els seus consells.
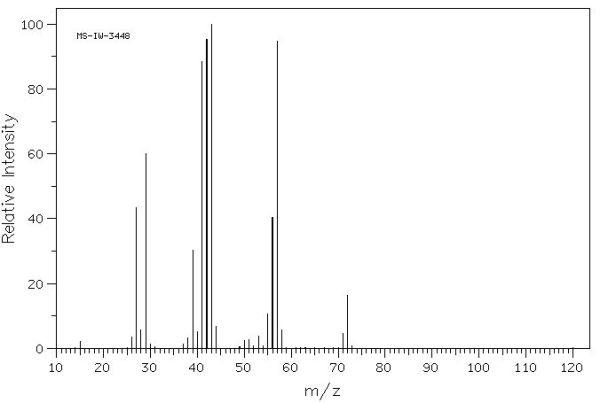
Bona tarda company, estic mirant-me l’espectre del 1-pentè i no acabo de veure d’on surt el pic amb m/z=42. Els de m/z=55 i el de 70 els tinc clars però aquest no el se veure, a no ser que sigui una cosa com CH-CH2-CH3+ que s’obtindria traient els 2 carbonis enllaçats amb el doble enllaç amb els seus respectius hidrògens i al que queda li traiem un altre hidrogen, però ho veig una mica rebuscat, no? Ja m’explicaràs. Cordialment,
Ferran
Hola Ferran,
Tens raó, no és un pic que es vegi d’immediat d’on surt. Son més raonables els pics a m/z 41 (CH2=CH-CH2+) i 43 (CH3-CH2-CH2+), però resulta que el pic a 42 és molt més intens. Es deu a un reagrupament dels àtoms, anomenat transposició de McLafferty, que te lloc en els hidrocarburs insaturats de 5 o més carbonis.
A la pàgina 300 del llibre de Pasto i Johnson (http://books.google.es/books?id=uHNdHS8JXFIC&lpg=PA291&ots=D2oNprIaJ7&dq=reagrupamientos%20mclafferty&hl=es&pg=PA300#v=onepage&q=reagrupamientos%20mclafferty&f=false) tens l’explicació per la transposició en els hidrocarburs insaturats (https://experimentaciolliure.files.wordpress.com/2012/10/reagrupament_mclafferty.jpg). En el nostre cas implica que es forma el ió CH2=CH-CH3+, amb relació m/z = 42, molt estable.
Aquest reagrupament també té lloc si el doble enllaç és amb un altre element, l’oxigen per exemple. Només cal que fiquis rreagrupamiento o transposició de McLafferty en Google i trobaràs un munt d’entrades que l’expliquen.
Ok. moltes gràcies Lorenzo. Sort que no ho he d’explicar al meus alumnes de batxillerat 😉 Com pot arribar a complicar-se el tema!
Ferran
[…] https://experimentaciolliure.wordpress.com/altres-materials/introduccio-a-lanalisi-espectroscopic-al-… […]