Fonaments de l’espectroscòpia infraroja
L’espectroscòpia infraroja (Espectroscòpia IR) és la branca de l’espectroscòpia que treballa amb la part infraroja de l’espectre electromagnètic. S’utilitza com altres tècniques espectroscòpiques, o en combinació amb elles, per a identificar un compost o investigar la composició d’una mostra. Els fotons de la radiació infraroja no tenen energia suficient per a provocar transicions electròniques en els àtoms, però si poden aconseguir canvis en les vibracions dels enllaços covalents de les molècules orgàniques.
Totes les molècules vibren, fins i tot a les més baixes temperatures. L’energia associada a la vibració molecular està quantitzada, igual que les energies electròniques dels àtoms i les molècules. Per a vibrar amb una energia més gran, una molècula ha d’absorbir un fotó d’una longitud d’ona específica de la regió de l’IR.
La regió de l’infraroig de l’espectre correspon a longituds d’ona que van des de 8 x 10-5 cm a 8 x 10-2 cm, o el que és el mateix de 14.000 a 10 cm-1, si s’expressa en números d’ona. La porció infraroja de l’espectre electromagnètic es divideix en tres regions, el infraroig proper, el mitjà i el llunyà, així nomenats per la seva relació amb l’espectre visible. D’aquest tres, l’infraroig mitjà (aproximadament 4000-400 cm-1) és el que s’usa per estudiar les vibracions fonamentals i l’estructura rotacional/vibracional en l’espectroscòpia IR.
Modes fonamentals de vibració
Els àtoms no es troben estàtics dins d’una molècula sinó que estan en moviment constant uns respecte als altres, vibrant a freqüències constants entorn dels enllaços que els uneixen. L’espectroscòpia infraroja es basa en el fet que les molècules tenen freqüències concretes a les quals roten i vibren, és a dir, els moviments de rotació i vibració moleculars tenen nivells d’energia discrets (modes normals vibracionals).
Les freqüències ressonants o freqüències vibracionals són determinats bàsicament per la forma de les molècules, la força dels enllaços i les masses dels àtoms. Així, la freqüència de les vibracions pot ser associada amb un tipus particular d’enllaç.
En tot cas, perquè una forma vibracional en una molècula sigui activa a l’IR, ha d’estar associada amb canvis en el moment dipolar mentre vibra, de manera que molècules simètriques difícilment absorbiran radiació IR.
Si la molècula és homonuclear, com el N2 i l’O2, no pot haver canvi en el seu moment dipolar (sempre serà zero) i no podran absorbir la radiació IR. Ara bé, si les molècules són diatòmiques però heteronuclears, com el CO o el NO, seran actives a l’IR, és a dir, absorbiran energia en aquesta regió ja que els seus moment dipolars canvien en canviar la longitud dels seus enllaços.
Les molècules diatòmiques simples tenen només un enllaç, que només es pot estirar i encongir. Les molècules més complexes poden tenir molts enllaços, i les diferents formes en les que vibren es poden combinar, portant a absorcions en l’infraroig a freqüències característiques que poden relacionar-se amb grups químics.
Per exemple, els àtoms en un grup CH2, que es troba en molts compostos orgànics poden vibrar de sis formes diferents, com són estiraments simètrics i asimètrics, flexions simètriques i asimètriques en el pla (scissoring i rocking, respectivament), i flexions simètriques i asimètriques fora del pla (wagging i Twisting, respectivament), com es mostra en els dibuixos a continuació:






Absorcions característiques dels grups funcionals
Com s’ha indicat, l’absorció de la radiació IR depèn sobretot de la naturalesa de l’enllaç i els àtoms involucrats, de manera que cada tipus d’enllaç absorbeix en una franja més o menys estreta de l’espectre, el que pot servir per caracteritzar els grups funcionals de la mostra. En tot cas, cada compost pur dona un espectre característic que el defineix. En la taula i el gràfic de sota es mostren les bandes associades a cada tipus d’enllaç:
| Enllaç | mínim nombre d’ona (cm-1) | nombre d’ona màxima (cm-1) | grup funcional |
| C – O | 1000 | 1300 | Alcohols i èsters |
| N – H | 1580 | 1650 | Amina o amida |
| C = C | 1610 | 1680 | Alquens |
| C = O | 1650 | 1760 | Aldehids, cetones, àcids, èsters, amides |
| O – H | 2500 | 3300 | Àcids carboxílics (banda molt ampla) |
| C – H | 2850 | 3000 | Alcans |
| C – H | 3050 | 3150 | Alquens |
| O – H | 3230 | 3550 | H enllaçat en els alcohols |
| N – H | 3300 | 3500 | Amina o amida |
| O – H | 3580 | 3670 | OH lliure en alcohols (només en les mostres diluïdes amb solvent no polar) |
Intervals d’absorció en l’IR de diferents tipus d’enllaç:

Si es vol més detall es pot consultar aquesta taula més completa.
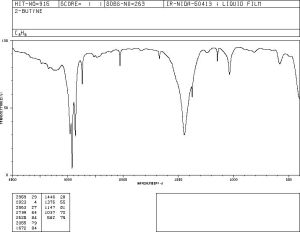
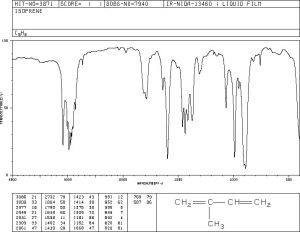
Exemples d’espectres d’IR
Exemples d’espectres de diferents tipus i de diferents compostos es poden aconseguir en les bases de dades de diferents entitats com el National Institute of Standars and Technology (NIST) del departament de comerç dels Estats Units o el National Institute of Advanced Industrial Science and Technology (AIST) de Japó.
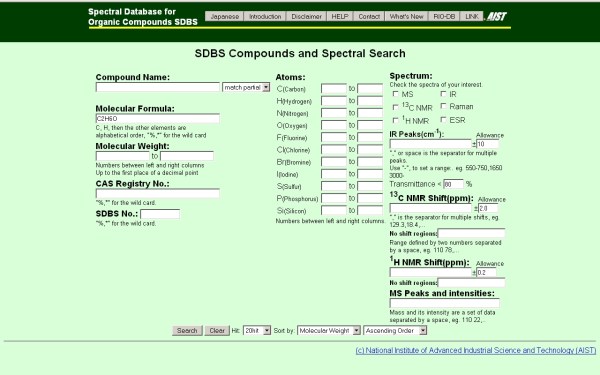
Malgrat que la pàgina del NIST està inicialment en castellà, utilitzarem la de l’AIST perquè resulta més fàcil guardar les gràfiques dels espectres. Comencem, doncs, accedint a la pàgina de l’AIST i acceptant les seves normes d’utilització, per passar a continuació a la pàgina on s’introdueix en les caselles corresponents la informació que es conegui del compost del que es vulgui el seu espectre. En el nostre cas escrivim C2H6O en la casella Molecular Formula.
Com es pot apreciar, dona diverses opcions per buscar el compost desitjat: pel nom, per la fórmula molecular, pel pes molecular (interval), pel nombre d’àtoms del compost, etc. A continuació es prem l’opció buscar (Search) i s’accedeix a una altra pàgina on apareixen els diferents isòmers (compostos amb la mateixa fórmula molecular) i els diferents espectres disponibles per cadascú:
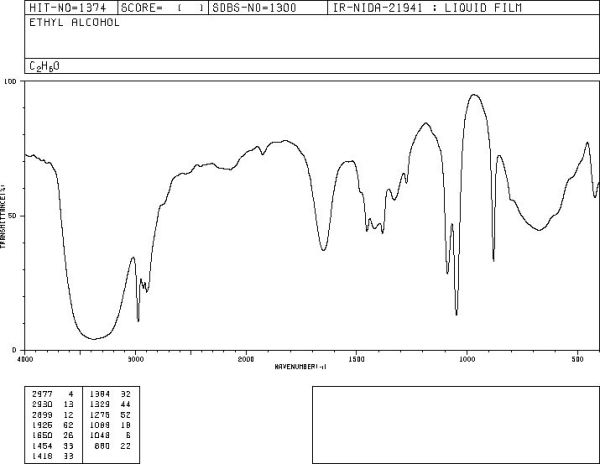
En aquest cas ofereix els dos isòmers possibles, l’alcohol etílic i el dimetil èter, i els espectres disponibles. Per l’etanol ofereix els tres que ens interessen (el de masses, MS, el de RMN i el d’infraroigs, IR), en concret ara el IR, sobre el que pitjarem.
I apareix l’espectre, que es pot guardar o copiar. S’observa que en abscisses hi és el nombre d’ona en cm-1 (wavenumber) i en ordenades la transmitància o quantitat de llum IR que ha travessat l’etanol, i per tant, els pics i bandes cap a baix indiquen on s’ha produït l’absorció de llum. En aquests cas es veu una absorció en una zona ampla entre 3200 i 3500 cm-1 característica de l’enllaç O – H dels alcohols.
De la mateixa manera s’han obtingut les gràfiques que venen a continuació, que poden servir per comprovar si apareixen absorcions a les freqüències donades en la taula o el gràfic de dalt.
Alguns exemples més
L’espectròmetre d’infraroig
Els primers equips comercials van aparèixer a mitjans del segle XX. Es va impulsat el seu desenvolupament durant la Segona Guerra Mundial, quan es van emprar en el control de la concentració i puresa del butadiè, utilitzat per a la síntesi de cautxú sintètic. En l’última dècada del segle XX van aparèixer en el mercat els espectròmetres de transformada de Fourier (tecnologia que no entrarem a estudiar), millorant les possibilitats d’aquesta tècnica. Els instruments són en l’actualitat petits i es poden transportar fàcilment, fins i tot pel seu ús en assaigs fora del laboratori.
Per analitzar una mostra, un raig de llum infraroja la travessa, i es registra la quantitat d’energia absorbida per a cada longitud d’ona. Això es pot aconseguir escanejant l’espectre amb un raig monocromàtic, el qual canvia de longitud d’ona a través del temps, o utilitzant una transformada de Fourier per mesurar totes les longituds d’ona a la vegada. A partir d’això, es pot traçar un espectre de transmitància o absorbància, el qual mostra a quins longituds d’ona la mostra absorbeix l’IR, i permet una interpretació de quins enllaços són presents.
És més habitual representar l’espectre de la radiació infraroja que absorbeix la mostra (espectre d’absorbància, que és l’utilitzat en aquest escrit) que no pas l’espectre de la radiació que deixa passar la substància analitzada (espectre de transmitància).
Amb mostres amb pocs enllaços actius a l’IR i alts nivells de puresa s’obtenen espectres nítids. Amb estructures moleculars més complexes apareixen més bandes d’absorció i donen un espectre més complex. No obstant això, aquesta tècnica s’ha pogut utilitzar també per a la identificació de mescles.
En mesurar a una freqüència específica al llarg del temps, es poden mesurar canvis en el caràcter o la quantitat d’un enllaç particular. Això és especialment útil per mesurar el grau de polimerització en la fabricació de polímers.
Preparació de la mostra
Les mostres gasoses requereixen poca preparació però s’ha d’utilitzar una cel·la llarga (usualment 5-10 cm) per encabir-les, ja que els gasos mostren absorbàncies relativament febles.
Les mostres líquides es poden disposar ficant una gota entre dues plaques d’una sal d’alta puresa, comunament cristalls de clorur de sodi, encara que també s’utilitzen altres sals com ara bromur de potassi o fluorur de calci. Les plaques de sal són transparents a la llum infraroja i no introduiran línies en l’espectre, però les plaques de sal són altament solubles en aigua, i per tant la mostra ha d’estar completament anhidra.
La manera més senzilla de preparar les mostres sòlides és moldre la mostra amb un agent aglomerant (usualment nujol) en un morter de marbre o àgata per formar una suspensió. Una fina pel·lícula de suspensió s’aplica entre les plaques de sal i es fa la mesura.
Un exemple d’un problema resolt
Com a subproducte en una síntesi s’ha obtingut una substància que, una vegada purificada i fet l’anàlisi elemental, dona una fórmula C4H8O i un espectre IR com el següent:
De quin compost es pot tractar, de la butanona, del propanal o del 3-buten-1-ol?
Solució:
Amb la mateixa fórmula molecular C4H8O tenim dos dels tres compostos isòmers pels que demana el problema:
CH3-CO-CH2-CH3
CH2=CH-CH2-CH2-OH
Ja que el propanal té per fórmula C3H6O i no por ser.
L’espectre IR té un marcat pic a 1050 cm-1, un altre a 1650 cm-1 i una banda a 3200-3500 cm-1, que podríem correspondre als enllaços C-O dels alcohols, a C=C dels alquens i al O-H dels alcohols, respectivament, i no s’aprecia un pic significatiu entre 1650-1760 cm-1 corresponent a l’enllaç C=O de les cetones.
Podem concloure que estem davant el 3-buten-1-ol.
Enllaços per ampliar informació
La Royal Society of Chemistry va publicar fa temps un llibre titulat Modern Chemical Techniques : An Essential Reference for Students and Teachers amb propostes per estudiar tècniques d’anàlisi espectroscòpic al que seria el nostre batxillerat (16 – 18 anys). Actualment (2015) amb el nom de Modern Chemical Techniques: background reading for chemistry teachers ha ficat a l’abast de tothom en format PDF i per capítols el contingut actualitzat d’aquell llibre. En concret pel que aquí interessa la unitat Modern chemical techniques: infrared spectroscopy.
A la web de Libretexts. Español es troben gran quantitat de llibres en espanyol de diferents disciplines i de lliure accés amb llicència de creative commons. Entre ells, a l’apartat de Química General, està Estructura y Reactividad en Química Orgánica, Biológica e Inorgánica II: Aspectos Prácticos de la Estructura – Purificación y Espectroscopia , que conté un capítol dedicat a l’Espectroscòpia infraroja que intercala exercicis resolts entre la teoria. El llibre ha estat escrit pel professor Chris Schaller del College of Saint Benedict a la Saint John’s University.
Han eliminat els continguts de l’estupenda web Quiored, escrita entre els anys 2002 i 2004 per un grup de professors i alumnes del Departamento de Química Orgánica de la facultat de ciències de la Universidad de Granada, però un dels seus creadors, el professor Jose A. Dobado, ha replicat una part d’ella a la web De Química on hi ha un apartat específic d’espectroscòpia infraroja dins la pestanya Laboratorio (Determinación estructural de Compuestos Orgánicos mediante Métodos Espectroscópicos).
El Grupo de Síntesis Orgánica de la Universidad Jaume I en 2003 va elaborar una sèrie de temes per l’assignatura de Fundamentos de Química Orgánica, entre els quals hi és el TEMA 9: Determinación de estructuras mediante métodos físicos. I.
Exemples d’espectres de diferents tipus i de diferents compostos es poden aconseguir en les bases de dades de diferents entitats com el National Institute of Standars and Technology (NIST) del departament de comerç dels Estats Units o el National Institute of Advanced Industrial Science and Technology (AIST) de Japó.